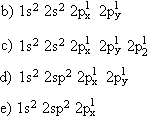Temos aqui novas postagens relacionadas ao ENEM. CONFIRAM !!!!
http://www.vestibulandoweb.com.br/quimica/prova-resolvida-unicamp-2010.asp
Estrutura Atômica
1. Número Atômico (Z)
É o número de prótons do núcleo de um átomo. É o número que identifica o átomo.
A representação do número atômico dos átomos é:
ZE
Num átomo neutro, cuja carga elétrica total é zero, o número de prótons é igual ao número de elétrons. O número de elétrons, nesse caso, pode ser considerado igual ao número atômico.
Exemplo:
O átomo de magnésio (Mg) tem número atômico 12 (Z = 12).
Significado: no núcleo do átomo de Mg existem 12 prótons. No átomo neutro de Mg existem 12 prótons e 12 elétrons.
2. Número de Massa (A)
É a soma do número de prótons (Z) e do número de nêutrons (N) existentes no núcleo de um átomo.
A = Z + N
Exemplo:
Um átomo neutro tem 19 prótons e 21 nêutrons, portanto:
Z = 19 e N = 21
A = Z + N = 19 + 21 = 40
3. Elemento Químico
É o conjunto de átomos que apresentam o mesmo número atômico (Z) (mesma identificação química).
Observações:
Como vimos anteriormente, um átomo é eletricamente neutro quando o número de prótons é igual ao número de elétrons, porém um átomo pode perder ou ganhar elétrons na eletrosfera, sem sofrer alteração no seu núcleo, originando partículas carregadas positiva ou negativamente, denominadas íons.
Se um átomo ganha elétrons, ele se torna um íon negativo, chamado ânion.
Se um átomo perde elétrons, ele se torna um íon positivo, chamado cátion.
4. Isótopos, Isóbaros e Isótonos
Isótopos: são átomos que apresentam o mesmo número atômico (Z) e diferentes número de massas (A).
Os isótopos são átomos de um mesmo elemento químico (mesmo Z), e que apresentam diferentes números de nêutrons, resultando assim diferentes números de massa.
|
Isóbaros: são átomos que apresentam diferentes números atômicos (Z) e mesmo número de massa (A).
|
Isótonos: são átomos que apresentam diferentes números atômicos (Z), diferentes números de massa (A), e o mesmo número de nêutrons.
|
Aulas do surgimento da Química , preparando os alunos para todo tipo de avaliação externa, envolvendo
essa disciplina.
Magia negra - Dos tempos pré históricos ao início da Era Cristã
Esta era uma era na qual as culturas Sumérias, Babilônica, Egípcias e Gregas estavam florescendo. Durante a maior parte deste período, o misticismo e a superstição prevalesceram sobre o pensamento científico. Nessa era, muitas pessoas acreditavam que os processos naturais eram controlados por espíritos, e que eles poderiam se utilizar de magia para persuadi-los a agir em seu favor. Muito pouco conhecimento químico foi conseguido, mas alguns elementos tais como o Ferro, Ouro e Cobre foram reconhecidos. Durante este tempo, os filósofos gregos Tales e Aristóteles especularam sobre a composição da matéria. Eles acreditavam que a Terra, Ar, Fogo e Água (alguns acreditavam em uma quinta substância conhecida como "quintessência", ou "éter") eram os elementos básicos que compunham toda a matéria. Pelo fim desta era, as pessoas aprenderam que o Ferro poderia ser conseguido a partir de uma rocha marrom escura, e o bronze poderia ser obtido combinando-se cobre e latão. Isso os levou a imaginar que se uma substância amarela pudesse ser combinada com uma mais dura, Ouro poderia resultar. A crença que o ouro poderia ser obtido a partir de outras substâncias iniciou uma nova era conhecida como Alquimia.
Alquimia - Do início da Era Cristã à metade do século XVII
Durante esta longa era, muitos alquimistas acreditaram que metais poderiam ser convertidos em ouro com a ajuda de uma "coisa" chamada "a pedra filosofal". Esta "Pedra filosofal" nucna foi encontrada, até onde se sabe, mas muitas descobertas de novos elementos e compostos foram feitas durante este período. No inísio co sédulo XIII, alquimistas como Roger Bacon, Albertus Magnus e Raymond Lully começaram a imaginar que a procura pela pedra filosofal era fútil. Eles acreditaram que os alquimistas poderiam servir o mundo de uma melhor maneira descobrindo novos produtos e métodos para melhorar a vida cotidiana. Isso iniciou uma corrente na qual os alquimistas pararam de buscar pela pedra filosofal. Um importante líder neste movimento foi Theophrastus Bombastus. Bombastus sentiu que o objetivo da alquimia deveria ser a cura dos doentes.
Ele acreditava que sal, enxofre e mercúrio poderiam dar saúde se combinados nas proporções certas. Este foi o primeiro período da Iatroquímica. O último químico influente nesta era foi Robert Boyle. Em seu livro: "O Químico Cético", Boyle rejeitou as teorias científicas vigentes e iniciou uma listagem de elementos que ainda hoje é reconhecida. Ele também formulou uma Lei relacionando o volume e pressão gos gases (A Lei de Boyle). Em 1661, ele fundou uma sociedade cient;ifica que mais tarde tornaria-se conhecida como a Sociedade Real da Inglaterra (Royal Society of England).
Química Tradicional - Da metade do século XVII ao meio do século XIX
A esta altura, os cientistas estavam usando "métodos modernos" de descobertas testando teorias com experimentos. Uma das grandes controvérsias durante este período foi o mistério da combustão. Dois químicos: Johann Joachim Becher e Georg Ernst Stahl propuseram a teoria do flogisto. Esta teoria dizia que uma "essência" (como dureza ou a cor amarela) deveria escapar durante o processo da combustão. Ninguém conseguiu provar a teoria do flogisto. O primeiro químico que provou que o óxigênio é essencial à combustão foi Joseph Priestly. Ambos o oxigênio e o hidrogênio foram descobertos durante este período. Foi o químico francês Antoine Laurent Lavoisier quem formulou a teoria atualmente aceita sobre a combustão. Esta era marcou um período aonde os cientistas usaram o "método moderno" de testar teorias com experimentos. Isso originou uma nova era, conhecida como Química Moderna, à qual muitos se referem como Química atômica.
Química Moderna - Da metade do século XIX até hoje
Esta foi a era na qual a Química floresceu. As teses de Lavoisier deram aos químicos a primeira compreensão sólida sobre a natureza das reações químicas. O trabalho de Lavoisier levou um professor inglês chamado John Dalton a formular a teoria atônica. Pela mesma época, um químico italiano chamado Amedeo Avogadro formulou sua própria teoria (A Lei de Avogadro), concernente a moléculas e suas relações com temperatura e pressão. Pela metade do século XIX, haviam aproximadamente 60 elementos conhecidos. John A. R. Newlands, Stanislao Cannizzaro e A. E. B. de Chancourtois notaram pela primeira vez que todos estes elementos eram similares em estrutura. Seu trabalho levou Dmitri Mendeleev a publicar sua primeira tabela periódica. O trabalho de Mandeleev estabeleceu a fundação da química teórica. Em 1896, Henri Becquerel e os Curies descobriram o fenômeno chamado de radioatividade, o que estabeleceu as fundações para a química nuclear. Em 1919, Ernest Rutherford descobriu que os elementos podem ser transmutados. O trabalho de Rutherford estipulou as bases para a interpretação da estrutura atômica. Pouco depois, outro químico, Niels Bohr, finalizou a teoria atômica. Estes e outroa avanços criaram muitos ramos distintos na química, que incluem, mas não somente: bioquímica, química nuclear, engenharia química e química orgânica.
Tentar-se-à mostrar um trabalho que satisfaça o ensejo de saber tudo sobre a mais obscura curiosidade que envolva as técnicas, os descobridores, as descobertas, e as mais curiosas maneiras de desenvolver e aprender a química de uma maneira saudável, muito abrangedora e claro satisfatória. Encontrar-se-à um estudo aprofundado sobre todos os pontos e dados sobre a história e o desenrolar da química. A química é explicada de maneira fácil de entender e de um incrível resultado.
Desenvolvimento
Conceito
Durante centenas de anos acumularam-se conhecimentos empíricos sobre o comportamento das substâncias e tentou-se organizar todas essas informações num corpo doutrinário. Somente a partir do século XIX, quando a soma de conhecimentos se tornou ampla e abrangente, foi possível estabelecer um vínculo teórico para a interpretação dos fatos e criar uma verdadeira teoria química. Química é a ciência que estuda as propriedades, a composição e a estrutura das substâncias (elementos e compostos), as transformações a que estão submetidas e a energia liberada ou absorvida durante esses processos. Toda substância, seja ela natural ou artificialmente produzida, é constituída por uma (ou mais) das centenas de espécies diferentes de átomos que foram identificados como elementos. Embora esses átomos se componham de partículas elementares, eles são os componentes básicos das substâncias químicas; não há quantidade de oxigênio, mercúrio ou ouro, por exemplo, que seja menor do que um átomo dessa substância.
A química, portanto, não se ocupa do universo subatômico, mas das propriedades dos átomos e das leis que regem suas combinações, além do modo como o conhecimento dessas propriedades pode ser utilizado para finalidades específicas.
Ramos da química
A amplitude dos campos estudados pela química e o grande número de interrelações com outras disciplinas científicas dificultam a classificação dessa ciência em ramos perfeitamente definidos e independentes. Ao longo do século XX, contudo, estabeleceu-se nos meios universitários a divisão da química em cinco grandes grupos: orgânica, inorgânica, físico-química, química analítica e bioquímica. Deve-se enfatizar, contudo, que tais subdivisões nunca foram, nem se espera que venham a ser, mutuamente exclusivas, pois o campo da química é um só, e há uma tendência natural para a unificação e remoção de barreiras artificiais. Outras disciplinas freqüentemente citadas em separado são a química molecular, a eletroquímica, a química nuclear, a radioquímica e a estereoquímica. Costuma-se ainda denominar química industrial ao conjunto de processos de produção de substâncias químicas de interesse econômico, o que pressupõe o conhecimento de técnicas fornecidas por todos os ramos anteriormente citados. Química orgânica e inorgânica.
A química orgânica e a inorgânica são subdivisões baseadas na natureza dos compostos que constituem seu objeto de estudo. Em geral definese a química orgânica como a química dos compostos de carbono, ou seja, do carbono combinado com outros elementos, principalmente hidrogênio, oxigênio, enxofre, nitrogênio, fósforo e cloro.
Os compostos estudados pela química orgânica incluem os componentes dos tecidos vegetais e animais, o petróleo e seus derivados, a hulha, os açúcares, o amido, a celulose, os plásticos e a borracha. Por exclusão, a química inorgânica concentra-se no estudo dos demais compostos químicos, inclusive aqueles em que o carbono não se encontra coordenado em cadeias, como os óxidos carbonados, carbonetos metálicos e alguns outros. Físico-química. A físico-química representa um método de abordagem de qualquer sistema químico, seja uma substância simples ou uma mistura de substâncias, sem estabelecer considerações sobre sua natureza orgânica ou inorgânica. A disciplina inclui o estudo de propriedades mensuráveis, o desenvolvimento de métodos experimentais e instrumentos para realizar medições, além da formulação de teorias, de preferência expressas em linguagem matemática, e a previsão dos valores das propriedades com o objetivo de compará-los aos resultados experimentais. Nesse campo, em que não há limite entre o fato químico e o fato físico, se incluem as pesquisas das chamadas física atômica, física nuclear, mecânica quântica atômica e molecular. Química analítica.
O campo da química analítica é o estudo e a determinação da composição dos sistemas químicos em termos dos elementos ou compostos que contêm. Divide-se em qualitativa e quantitativa. A qualitativa restringe-se apenas à detecção e identificação dos constituintes, enquanto a quantitativa lhes determina a grandeza. Essa divisão da química, assemelhada à tradição empírica dos métodos químicos da antiguidade, sofreu nos últimos séculos uma progressiva aproximação dos processos da físico-química.
Apesar dos modernos métodos analíticos, porém, os processos de pesquisa puramente analítica, inspirados na dissecação de uma mistura complexa em seus componentes simples por métodos químicos, encontram crescente aplicação em determinados estudos sobre poluição das águas e do ar. A química analítica também tem grande importância científica e prática em várias áreas da pesquisa e da indústria, bem como em mineralogia, geologia, medicina, farmácia, agricultura, metalurgia, energia nuclear etc. Bioquímica. Também chamada química biológica, a bioquímica situa-se na fronteira entre a química e a biologia. Trata da composição química da matéria viva e dos processos químicos que ocorrem nos organismos vivos.
Desempenha importante papel nos campos da agricultura, bacteriologia, farmacologia, medicina e odontologia. Outras classificações. Nas últimas décadas do século XX propuseram-se subdivisões da química consideradas a partir de diferentes perspectivas. Entre elas destacou-se a classificação sugerida em 1971 pelo periódico americano Chemical Abstracts (publicada pela Sociedade Americana de Química), que enumerava oitenta campos agrupados em cinco disciplinas globais: (1) bioquímica; (2) química orgânica; (3) química macromolecular, extraída da tradicional química orgânica e especializada no estudo de polímeros, com especial atenção aos plásticos, fibras têxteis e vegetais e produtos derivados; (4) química aplicada e engenharia química; e (5) química física e analítica. História 2.3 - História Inicialmente, durante um longo período, o espírito de manipulação dos meios naturais pelo homem se reduziu à mera modelação de materiais, como a pedra, o osso e a madeira, a fim de transformá-los em utensílios. Mais tarde, a invenção das primeiras técnicas metalúrgicas representou uma autêntica revolução em todos os aspectos da atividade das sociedades primitivas. O ofício do ferreiro, artífice das primeiras transformações químicas controladas pelo homem na história, adquiriu um valor predominante nessas comunidades. Seu trabalho -- como sugerem numerosos estudos antropológicos sobre os povos antigos -- relacionava-se com aspectos da divindade e imbuía-se de conotações mágicas e religiosas. Desde tempos remotos se conhecem os metais ouro, prata, cobre, estanho e chumbo.
A obtenção do mercúrio a partir do mineral cinabre, descrita por Teofrasto por volta do ano 300 a.C., teve grande importância na evolução da metalurgia, devido a sua capacidade de dar coesão a ligas metálicas, e coincide com os mais antigos registros da existência da alquimia. Amplamente praticada nas grandes civilizações da antiguidade, como a chinesa, a indiana e a egípcia, a alquimia aspirava, mediante técnicas de transmutação dos elementos da natureza, ao bem-estar do homem, traduzido em três objetivos principais: riqueza, longevidade e imortalidade. Com essa finalidade os alquimistas buscaram obter a pedra filosofal, que transformaria as substâncias impuras em metais nobres, e o elixir da eterna juventude; seus textos, supostos depositários do conhecimento divino, são repletos de símbolos criptográficos e frases freqüentemente indecifráveis. Dois dos princípios fundamentais da alquimia -- a volatilidade, simbolizada pelo mercúrio, e a combustibilidade, pelo enxofre -- representaram notáveis progressos na pesquisa científica.
Os alquimistas trataram os metais com vitríolos (sulfatos de cobre e de ferro), alunitas (sulfatos de alumínio e de potássio) e cloretos de sódio e de amônia. O importante impulso que deram à ciência experimental transparece no fato de que os aparelhos tradicionais dos laboratórios químicos atuais procedem do instrumental que os alquimistas usaram em seus processos prediletos de experimentação (sublimação, combustão de substâncias): destiladores, retortas, provetas etc. Além disso, em seus aspectos práticos, distanciados da simbologia mágica, a alquimia contribuiu notavelmente para o desenvolvimento da medicina, com a fabricação de pomadas, bálsamos e ungüentos. A influência dessa ciência primitiva se prolongou até o início do século XIX, mas com um parêntese na bacia mediterrânea oriental, com o apogeu da Grécia clássica. As anotações de pensadores célebres como Leucipo e seu discípulo Demócrito, autor de uma teoria atômica parecida com a exposta no século XIX por John Dalton, que culminou nos trabalhos de Aristóteles sobre filosofia natural, contêm excelentes idéias e ao mesmo tempo grande número de imprecisões científicas, em decorrência de seu caráter, mais dado à especulação abstrata que às realizações empíricas. Islã e cristandade. As origens da alquimia nas nações islâmicas são pouco conhecidas, embora nela se perceba a influência do saber grego e oriental. Os escritos de al-Razi e de Jabir (ou Geber, na forma latinizada, personagem misterioso que parece ser na verdade um conjunto de autores ocultos sob o pseudônimo para fugir das perseguições religiosas contra a ciência na Bagdá do século X) projetaram o conhecimento dos árabes na Europa através da fronteira espanhola e mediante intercâmbios marítimos.
O pensamento do cordovês Avicena, que representou a vertente da alquimia orientada para fins curativos, foi o ponto mais alto do saber médico da Idade Média. O inglês Francis Bacon e o alemão Alberto Magno, teólogo e filósofo canonizado pela Igreja Católica, assimilaram os ensinamentos árabes e os uniram à interpretação das doutrinas aristotélicas próprias da época medieval até alçar a alquimia européia a um nível comparável ao das civilizações que a precederam. No século XVI, a química européia recebeu o impulso dado pelo médico suíço Paracelso, que, com formas próprias da alquimia, assentou as bases da moderna química médica ao combinar adequadamente as observações de Avicena e dos sábios gregos da antiguidade. A concepção racionalista da física e da astronomia marcou o início do declínio da alquimia especulativa que imperava na época, e a destacada obra de Robert Boyle, que definiu já no século XVII a noção de elemento como um primeiro passo em direção às teorias modernas da química, simbolizou a decadência de uma visão das transmutações da matéria que, embora sustentada durante várias décadas por algumas áreas de pesquisa, sucumbiu progressivamente ante certas idéias ordenadas e vigorosas fundamentadas em princípios universais de inspiração natural e distanciados da mística que os caracterizara em tempos anteriores. Química científica.
A química dos séculos XVII e XVIII alcançou um estado de desenvolvimento e abstração claramente inferior ao adquirido por outras disciplinas científicas. Durante esse período, sua fonte básica de inspiração foi a obra de Isaac Newton Opticks (1704; Óptica), em cujos apêndices finais o físico britânico expôs um conjunto de hipóteses sobre a natureza corpuscular da matéria. A teoria global mais destacável elaborada durante o século XVII, devida a Johann Joachim Becher e Georg Ernst Stahl, explicava o comportamento dos gases e o fenômeno do fogo como derivados de um único princípio natural, a que denominaram flogístico, que seria responsável pelos processos de combustão, calcinação e respiração. O ar, como receptáculo do flogístico, e os metais, como geradores do flogístico na combustão, tinham papel preponderante na pesquisa química. As descobertas realizadas no fim do século XVIII por Georg e Joseph Black (o dióxido de carbono) e Joseph Priestley (o oxigênio, ao qual denominou ar desflogisticado) representaram como que um prelúdio ao surgimento da primeira doutrina metodológica da química, iniciada com o francês Antoine-Laurent Lavoisier, que em seus postulados teóricos equiparou essa disciplina à tradicionalmente mais estruturada ciência física. A formulação, por Lavoisier, de uma teoria da combustão, devida ao oxigênio e não ao flogístico, e os esforços que ele e outros pesquisadores empreenderam para estabelecer uma nomenclatura química geral e racional assinalaram o início de uma nova etapa no desenvolvimento dessa ciência. Composição química.
Durante o século XVIII dedicou-se grande atenção à questão da afinidade, nome que se dava à força que mantinha ligados os compostos químicos: julgava-se que o grau de afinidade de um dado grupo de elementos podia ser capaz de tomar o lugar de outro num determinado composto. Em 1808, aceitava-se a idéia de que os compostos possuíssem composições fixas. Uma explicação para tal fato foi proporcionada pela primeira teoria atômica verdadeiramente química, a de John Dalton. Afirmava ele que cada elemento consistia em seu próprio tipo de átomos, cada qual com tamanho e peso característicos. Entrava em cena a idéia de peso atômico, embora Dalton não dispusesse de meios para calcular os pesos atômicos ou o número de átomos presentes num composto. Contudo, supunha ele que a composição constante dos compostos fosse devida à combinação de um número constante de átomos. As limitações impostas à generalização da teoria de Dalton por seus postulados rígidos foram em grande parte removidas pelas investigações de Joseph-Louis Gay-Lussac, segundo o qual quantidades equivalentes de elementos diferentes podiam combinar-se entre si, mas não fez distinção entre átomos e moléculas.
Em 1811 Amedeo Avogadro propôs para a controvérsia uma solução que obteve o reconhecimento geral depois de transcorridas várias décadas: a unidade de matéria é o átomo, mas a célula básica das reações químicas é a molécula, ou agrupamento de átomos que define a natureza dos diferentes compostos, de maneira que os mesmos átomos podem formar moléculas diferentes em função de diferentes proporções ou estruturas de combinação. Entretanto, o trabalho de Avogadro foi desprezado durante quase meio século. Entrementes, o sueco Jöns Jacob Berzelius realizava estudos analíticos de minerais e, com base na lei Dulong-Petit, preparava uma tabela de pesos atômicos, de modo geral exatos. Berzelius contribuiu também com a descrição dos fenômenos da catálise e isomeria e com a invenção do moderno sistema de símbolos químicos. Sua principal contribuição teórica foi a teoria dualista ou eletroquímica da combinação atômica, na qual buscou solucionar o velho problema da natureza da afinidade. Acreditava que todos os átomos apresentassem o velho problema da natureza da afinidade.
Acreditava que todos os átomos apresentassem carga elétrica, tanto positiva como negativa, mas que a positiva predominasse em alguns e a negativa em outros. Os átomos de carga negativa seriam mantidos ligados aos de carga positiva mediante forças eletrostáticas. O maior conhecimento de compostos de carbono que resultou do estudo intensivo da química orgânica na primeira metade do século XIX viria desmentir essa teoria dualista. Os químicos passaram então a conjeturar quanto à existência de radicais, isto é, grupos de átomos que atuariam como uma unidade nas reações químicas. Julgava-se que dois radicais ligados a um átomo de oxigênio (para formar um éter) pertencessem ao tipo água, e que três radicais ligados a um átomo de nitrogênio (para formar uma amina) pertencessem ao tipo amônia.
A polêmica quanto ao uso de pesos moleculares ou atômicos ou de equivalentes na notação de fórmulas aumentava a confusão criada pelas tentativas de enquadrar todos os compostos orgânicos em alguns poucos tipos rígidos. A teoria tipológica pelo menos sugeria que um átomo individual só era capaz de prender um número limitado de átomos de outros elementos ou radicais. O conceito de "unidades de afinidade" transformou-se gradualmente no moderno conceito de valência, passo importante para a elucidação da natureza dos compostos orgânicos. Em 1858, August Kekulé e Archibald Scott Couper propuseram a tetravalência do carbono e sua propriedade de unir-se a outros átomos de carbono, formando longas cadeias, o que abriu caminho para o desenvolvimento da teoria estrutural dos compostos orgânicos. Nesse desenvolvimento destacou-se o químico Aleksandr Butlerov. Na década de 1870, Jacobus Henricus van't Hoff e Joseph-Achille Le Bel praticamente inauguraram o campo da estereoquímica, ao postularem um átomo de carbono tetraédrico.
Tabela periódica. Em 1860, realizou-se em Karlsruhe, Alemanha, o primeiro congresso químico internacional, numa tentativa de solucionar a confusão reinante na teoria química, especialmente com relação aos pesos químicos. O italiano Stanislao Cannizzaro exumou a hipótese de Avogadro e demonstrou como os átomos e moléculas podiam distinguir-se entre si. A verificação dos verdadeiros pesos atômicos e moleculares possibilitou a complementação de estudos anteriores para classificação das propriedades dos elementos em termos de seus pesos atômicos. Dmitri Mendeleiev e Lothar Meyer propuseram versões de tabelas periódicas, e Mendeleiev previu a existência e propriedades de três elementos até então desconhecidos.
A descoberta posterior desses elementos (gálio, em 1875; escândio, em 1879; e germânio, em 1886), de acordo com as previsões, faz com que a lei de periodicidade fosse universalmente aceita e deu aos químicos uma generalização sistemática sobre a qual basearam sua ciência. A química do século XIX conseguiu ainda duas descobertas de importância transcendental: as técnicas de espectrografia, devidas a Robert Bunsen e Gustav Kirchhoff em 1859, que permitem deduzir a composição das substâncias segundo a energia absorvida por seus átomos a diferentes freqüências características de luz; e a tabela periódica dos elementos químicos, criada independentemente por Dmitri Mendeleiev e Julius Lothar Meyer, que criou uma classificação estruturada de todas as classes de átomos conhecidas e ainda não descobertas, de cuja simples análise se podem extrair conclusões sobre a composição atômica e as propriedades físicas e químicas de cada elemento. Século XX.
O desenvolvimento da química ao longo do século XX apoiou-se na confirmação experimental da teoria atômica, em estreita conexão com os avanços da física. Comprovou-se a existência de partículas subatômicas, Ernest Rutherford e Niels Bohr elaboraram modelos atômicos, e Max Planck lançou os fundamentos da mecânica quântica. A explosão tecnológica e industrial do século XX, como conseqüência de avanços científicos acelerados, deu origem ao nascimento das grandes indústrias químicas.
A química médica e farmacêutica e a química de polímeros (plásticos, fibras, derivados do petróleo etc.) experimentaram um desenvolvimento espetacular na segunda metade do século e influíram diretamente sobre os hábitos sociais com o lançamento no mercado de consumo de inovadores utensílios fabricados com diversos materiais e a universalização da distribuição de medicamentos e outros produtos terapêuticos.
Além disso, outros numerosos aspectos da vida cotidiana, como a alimentação, a agricultura e o tratamento de combustíveis ganharam novos enfoques paralelamente às descobertas de uma ciência em contínua evolução. Princípios fundamentais Desde a revolução experimentada pelas ciências químicas no princípio do século XIX, um dos principais objetivos perseguidos pelos especialistas foi o estabelecimento de postulados metodológicos em grande parte inspirados nos modelos preexistentes da física e da matemática.
Os enunciados modernos da filosofia da ciência defendem que o progresso científico resulta da confrontação entre dois pontos de vista complementares: as concepções teóricas dos fenômenos, que analisam e sintetizam os dados experimentais e conformam conjuntos de hipóteses destinados a explicar os fatos e prever as situações futuras; e as comprovações empíricas, que julgam a validez e a oportunidade de sua aplicação. São os seguintes os princípios gerais mais comumente aceitos para a abordagem teórica dos sistemas químicos. (1) Utilidade dos modelos teóricos, entendidos como conjuntos de premissas expressas de forma matemática que constituem o núcleo básico de partida para a análise de um problema e seus desdobramentos.
O uso de modelos, como o do gás ideal que sustentou a enunciação de leis dos gases perfeitos durante os séculos XVII e XVIII, assim como os avançados sistemas configurados pelos computadores a partir de extensas enumerações de dados, se fundamenta na restrição das particularidades conhecidas do fenômeno até conseguir uma teoria completa e situações absolutamente previsíveis dentro de seus postulados. (2) Estrutura atômica, segundo a qual a matéria se compõe fundamentalmente de átomos, internamente formados de um pequeno núcleo que consiste na aglomeração de partículas elementares positivas (prótons) e neutras (nêutrons) unidas entre si por forças de coesão nuclear, e um conjunto de elétrons ou unidades elementares de carga elétrica negativa distribuídos em distintos níveis de energia e ligados ao núcleo por atração eletromagnética. A união de átomos gera moléculas, e as reações químicas se devem ao intercâmbio de elétrons entre moléculas. (3) Equilíbrios energéticos de acordo com a mecânica quântica, especialidade científica que postula a existência de regiões do espaço do átomo, chamadas orbitais e distribuídas em níveis, nas quais se organizam seus elétrons em pares ou isoladamente
. O movimento de elétrons entre os diferentes níveis de orbitais explica não só os fenômenos energéticos do átomo, expressos sob formulações quânticas de alta complexidade matemática, como também o estabelecimento de ligações químicas. (4) Validade do conceito de valência química, número inteiro com sinal positivo ou negativo que quantifica a natureza da participação dos átomos de um elemento em sua combinação com outros. Esse conceito, manejado desde a antiguidade, se manteve nas explicações atuais como a quantidade de elétrons que intervém numa reação química por cada classe de elementos participantes, e se complementa adequadamente com a teoria de orbitais atômicos. Peso atômico e mol. A essas considerações teóricas devem corresponder técnicas de medida adequadas, baseadas na definição de grandezas e princípios básicos de experimentação. Também é fundamental definir unidades métricas reprodutíveis mediante um instrumental preciso e completo.
Ciência de inspiração puramente empírica e carente de concepções perfeitamente delimitadas no momento de sua invenção, a química conserva duas noções fundamentais de natureza experimental: o peso atômico, posteriormente definido como a acumulação de partículas elementares positivas ou prótons do núcleo atômico; e o mol, equivalente a 6,023 x 1023 moléculas ou átomos (número de Avogadro), segundo a natureza do composto, e definido como o peso molecular (soma de pesos atômicos dos átomos de uma molécula) ou atômico, expresso em gramas, que constitui a unidade básica de quantidade química. Finalmente, as leis dos intercâmbios químicos se regem antes de tudo por equilíbrios de energia que determinam a viabilidade, a duração e a espontaneidade dos processos.
A análise energética das reações químicas, apoiada nos princípios da termodinâmica, constitui a síntese teórico-prática da maioria das questões pesquisadas pelas diferentes disciplinas da química. Nomenclatura química A utilização de nomes para tudo o que a química representa foi e continua sendo uma de suas maiores preocupações. Cada princípio e conceito fundamental, assim como os elementos, os compostos e uma quantidade de outros fatores, precisa ser assinalado com uma palavra ou combinação de palavras.
Para completar esse requisito, tem-se procurado chegar a uma linguagem química coerente. A palavra átomo é uma das mais antigas desse vocabulário e quando se relaciona a uma reação química comum significa o mesmo que quando foi utilizada pela primeira vez por Demócrito, por volta do ano 400 a.C. É a unidade mínima de matéria (sem considerar a fissão nuclear) nas reações químicas, da qual se formam as moléculas ou compostos. Cada átomo tem um símbolo constituído de uma ou duas letras associadas ao nome do elemento. Tem-se, assim, "Fe" como símbolo do elemento ferro, "Ca" para o elemento cálcio etc. Substância é a palavra que se aplica à matéria de composição uniforme e constante, com uma série de propriedades químicas.
Conseqüentemente, só se podem chamar de substâncias os elementos e compostos. Até quase o fim do século XVIII, nenhuma tentativa sistemática havia sido feita para designar as substâncias químicas, de modo a indicar sua composição. Os nomes então em uso eram mais ou menos arbitrários: podiam ser termos da velha alquimia, ou derivar-se do nome de seu descobridor (por exemplo, o sal de Glauber, muito usado pelo alemão Johann Rudolf Glauber), ou ainda baseavam-se em alguma semelhança superficial.
Assim, o tricloreto de antimônio, por seu aspecto amanteigado, se denominava manteiga de antimônio; o cloreto de zinco, manteiga de zinco. Essas substâncias eram classificadas junto com a manteiga de leite. O mesmo sucedia com o óleo de vitríolo (ácido sulfúrico), óleo de oliva etc. Torbern Olof Bergman e Louis Bernard Guyton de Morveau, de forma simultânea e independente, tentaram projetar um sistema mais completo para denominar os compostos químicos.
A sistematização da nomenclatura apresentada por Lavoisier e a notação química proposta por Jöns Jacob Berzelius, que criou símbolos para os elementos, são empregadas ainda hoje. 2.4 -
Conclusão
Conclui-se, um trabalho de sustância relativamente alta, pois todo o desenroscar da obra foi dada com a simplicidade e ao mesmo tempo uma culta explicação rápida e explicativa dos mais ínfimos trabalhos realizados sobre o assunto acima relacionado. Abrangemos todos e os mais variados fatos sobre a história da química.
EXERCÍCIOS RELACIONADO AS ATIVIDADES
Há candidatos que ficam alucinados tentando resolver esse dilema, que fica procurando uma vocação, um aviso. Dizem, que a única vocação do ser humano é não ter vocação nenhuma. Isso quer dizer que a opção por uma carreira tem haver com a história particular de cada um, sua educação, seu ambiente social, sua experiência de vida.
Não adianta esperar que alguém ou algum tipo de auto-ajuda identifique sua forte inclinação para uma carreira determinada. Os orientadores vocacionais dizem que os estudantes esperam que alguém lhes diga qual carreira seguir.
O questionário a seguir é um teste vocacional dos mais empregados. Você lerá uma série de atividades apresentadas aos pares, com letras "A" e "B". Algumas dessas atividades parecerão estranhas, mas não estão aí à toa. Lendo as alternativas, assinale "A" ou "B" , estando também livre para marcar as duas ou nenhuma.
Em cada um dos grupos, some o número de respostas "A" do quadro amarelo, com o número de respostas "B" do quadro bege e anote o resultado em algum rascunho. Ao terminar, pegue todos resultados dos grupos e confira o resultado na página gabarito do seu teste vocacional.
|
|
| Soma de respostas "A" do amarelo | + | Soma de respostas "B" do bege | = | Soma total do grupo = "pontos do grupo" |
|
Grupo I - você prefere :
- A – ler sobre eletricidade
- B – ler sobre física nuclear - A – Observar planetas no telescópio
- B – Observar células no microscópio
- A – ler sobre a fabricação de tintas
- B – ler sobre métodos de calcular - A – obter bolsa para estudar química
- B – obter bolsa p/ estudar educação
- A – Fazer o projeto de um viaduto
- B – Traduzir um romance - A – Fazer experiência em laboratório
- B – Fazer modelagem e desenho | - A – ler sobre mecânica
- B – ler sobre física quântica - A – estudar ossos do corpo humano
- B – conhecer mecanismo de máquina
- A – resolver problemas matemáticos
- B – resolver problemas com objetos
- A – Visitar um orfanato
- B – Visitar um museu de ciências
- A – ler obras de escritores famosos
- B – conhecer trabalhos de físicos
- A – Visitar uma galeria de arte
- B – Conhecer aparelho de laboratório |
|
|
Grupo II - você prefere :
- A – Conhecer as leis da genética
- B – Conhecer como funciona o motor - A – Visitar um laboratório biológico
- B – Visitar exposição farmacêutica
- A – Estudar respiração dos peixes
- B – Estudar c/ máquina calculadora - A – Analisar propriedades das frutas
- B – Fazer estudo sobre desemprego
- A – Ler sobre reprodução das aves
- B – Ler sobre literatura - A – Fazer experiências com plantas
- B – Fazer decoração e paisagismo | - A – Estudar a composição atmosfera
- B – Estudar o DNA - A – Ir a laboratório de análise clínica
- B – Assistir palestra sobre imunologia
- A – Determinar o custo de 1 máquina
- B – Pesquisar a cura da Aids
- A – Estudar sobre delinquência
- B – Observar comportamento animal
- A – Obter uma bolsa de literatura
- B – Obter uma bolsa de biologia
- A – ler a seção variedades de jornal
- B – ler sobre importância vitamínicas |
|
|
Grupo III - você prefere :
- A – Visitar um asilo de velhos
- B – Visitar uma usina nuclear - A – Estudar o problema do menor
- B – Observar os insetos
- A – Fazer entrevista sobre educação
- B – Organizar e tabular pesquisas - A – Ajudar c/ problemas de criança
- B – Ajudar famílias de migrantes
- A – Ser voluntário programas sociais
- B – Participar de curso de redação - A – ler sobre a produção de drogas
- B – ler sobre arte clássica | - A – Obter bolsa de estatística
- B – Obter bolsa de pedagogia - A – Analisar composição alimentícia
- B – Analisar causas de desemprego
- A – Calcular o custo de vida
- B – Estudar as condições sociais
- A – Ajudar a combater a mendicância
- B – Ajudar na educação de favelados
- A – Estudar informática
- B – Estudar métodos de erradicação
- A – Desenhar modelos de roupa
- B – Orientar crianças para o trânsito |
|
|
Exercícios sobre Distribuição Eletrônica
A
distribuição eletrônica seguindo o diagrama de Linus Pauling é feita
segundo a ordem crescente de energia, que é dada pelas setas.
Por Jennifer Rocha Vargas Fogaça

-

-
-
-
-
Questão 1
Faça a distribuição eletrônica em níveis de energia para os seguintes elementos:
a) 9F
b) 10Ne
c) 15P
d) 28Ni
e) 56Ba
-
Questão 2
(ITA-SP) No esquema a seguir, encontramos duas distribuições eletrônicas de um mesmo átomo neutro:
A 1s2 2s2 B 1s2 2s1 2p1
A seu respeito é correto afirmar:
a) A é a configuração ativada.
b) B é a configuração normal (fundamental).
c) A passagem deA para B libera energia na forma de ondas eletromagnéticas.
d) A passagem de A para B absorve energia.
e) A passagem de A para B envolve perda de um elétron.
-
Questão 3
Utilizando o diagrama de Pauling, realize a distribuição eletrônica do
elemento tungstênio (W), cujo número atômico (Z) é igual a 74 e,
posteriormente, forneça:
a) A distribuição eletrônica em ordem de energia;
b) A ordem geométrica;
c) O número total de elétrons por camada;
d) O número de elétrons no subnível mais energético;
e) O número de elétrons no subnível mais externo.
-
Questão 4
(UNI-RIO)“Os implantes dentários estão mais seguros no Brasil e já
atendem às normas internacionais de qualidade. O grande salto de
qualidade aconteceu no processo de confecção dos parafusos e pinos de
titânio, que compõem as próteses. Feitas com ligas de titânio, essas
próteses são usadas para fixar coroas dentárias, aparelhos ortodônticos
e dentaduras, nos ossos da mandíbula e do maxilar.”
Jornal do Brasil, outubro 1996.
Considerando que o número atômico do titânio é 22, sua configuração eletrônica será:
a) 1s 2 2s 2 2p 6 3s 2 3p 3
b) 1s 2 2s 2 2p 6 3s 2 3p 5
c) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2
d) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2
e) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6
Distribuição Eletrônica - Exercícios
|
-->
-->


Exercícios sobre distribuição eletrônica
Leia o artigo: Distribuição Eletrônica
Questões:
01.
(ACAFE) Considerando-se um elemento M genérico qualquer, que apresenta
configuração eletrônica 1s2 2s2 2p6 3s2 3p6 4s2 3d5, pode-se afirmar
que:
I. seu número atômico é 25;
II. possui 7 elétrons na última camada;
III. apresenta 5 elétrons desemparelhados;
IV. pertencem a família 7A.
Estão corretas as afirmações:
a) I, II e III somente
b) I e III somente
c) II e IV somente
d) I e IV somente
e) II, III e IV somente
02. (UFSC) O número de elétrons em cada subnível do átomo estrôncio (38Sr) em ordem crescente de energia é:
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
b) 1s2 2s2 2p6 3s2 3p6 4s2 4p6 3d10 5s2
c) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
d) 1s2 2s2 2p6 3s2 3p6 4p6 4s2 3d10 5s2
e) 1s2 2s2 2p6 3p6 3s2 4s2 4p6 3d10 5s2
03. (ABC) De acordo com e regra de Hund, estrutura eletrônica do átomo de carbono, no estado fundamental, é representada por:
a) 1s2 2s2 3p2
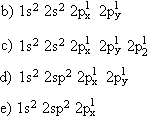
04. Conceitue orbital de um elétron.
05. Indique a distribuição eletrônica do oxigênio (Z = 8) no estado fundamental.
06. (ITA) O número máximo de orbitais atômicos correspondente ao número quântico principal é:
a) n
b) 2n
c) 2n + 1
d) n2
e) 2n2
07. (CESCEM) Qual dos valores abaixo pode representar
o número atômico de um átomo que, no estado fundamental, apresenta
apenas dois elétrons de valência?
a) 16
b) 17
c) 18
d) 19
e) 20
08. (FUVEST) Em um átomo, quantos elétrons podem ocupar o orbital p representado na figura?
a) 2
b) 3
c) 4
d) 5
e) 6
09. (PUC) O número normal de subníveis existentes no quarto nível energético dos átomos é igual a:
a) 1
b) 2
c) 3
d) 4
e) 5
10. (OSEC) Sendo o subnível 4s1 (com um elétron) o mais energético de um átomo, podemos afirmar que:
I. o número total de elétrons desse átomo é igual a 19;
II. esse apresenta quatro camadas eletrônicas;
III. a sua configuração eletrônica é 1s2 2s2 2p6 3s2 3p6 3d10 4s1
a) Apenas a firmação I é correta.
b) Apenas a firmação II é correta.
c) Apenas a firmação III é correta.
d) As afirmações I e II são corretas.
e) As afirmações II e III são corretas.
Grupo V - você prefere :





 Antoine-Laurent de Lavoisier (Foto: Reprodução)
Antoine-Laurent de Lavoisier (Foto: Reprodução)